

Objetivo de projeto conduzido no Instituto de Física de São Carlos da USP é entender como mutações observadas nas septinas humanas estão associadas a doenças. Conhecimento poderá ser útil para o desenvolvimento de fármacos (imagem: IFSC-USP/divulgação)
Publicado em 11/08/2021
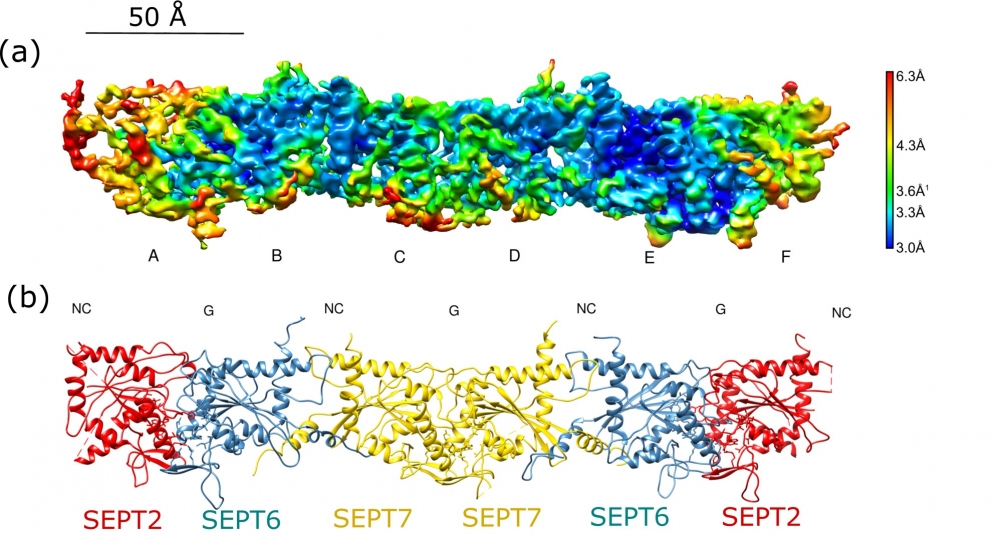
Agência FAPESP* – Pesquisadores da Universidade de São Paulo (USP) conseguiram desvendar a estrutura de um complexo de proteínas humanas conhecidas como septinas, que são essenciais para a divisão celular e atuam no estágio final desse processo.
Um dos objetivos da pesquisa é entender as consequências de algumas mutações observadas nessas moléculas, que têm sido associadas com doenças específicas, como a infertilidade masculina. Conhecer a estrutura tridimensional das septinas humanas também pode ajudar a entender anomalias relacionadas a enfermidades como Alzheimer, Parkinson e algumas formas de câncer. Pode ainda jogar luz sobre a relação entre o vírus zika e a microcefalia.
O estudo vem sendo conduzido pelo Grupo de Biofísica e Biologia Estrutural do Instituto de Física de São Carlos (IFSC-USP), que utilizou a técnica de criomicroscopia eletrônica em vez da tradicional difração de raios X, que requer a formação de um cristal da proteína para a realização do experimento que irá determinar sua estrutura.
A nova técnica apresenta algumas vantagens. Com ela é possível realizar o estudo da molécula em solução, congelando a amostra de forma rápida em uma fina camada de gelo e permitindo, dessa forma, que se observem as posições atômicas e todos os pormenores moleculares em alta resolução.
Coordenado pelo professor Richard Garratt, do IFSC-USP, o trabalho foi publicado no Journal of Molecular Biology. A investigação teve apoio da FAPESP por meio do Projeto Temático “Septinas: estudos comparativos visando correlacionar estrutura e função” e do projeto “EMU: aquisição de microscópio eletrônico de transmissão para criomicroscopia eletrônica de partículas isoladas - estabelecimento de uma instalação aberta de criomicroscopia eletrônica no CNPEM”.
A aluna de doutorado Deborah Cezar Mendonça, que é bolsista da FAPESP, foi a responsável pelo estudo.
Em entrevista à Assessoria de Imprensa do IFSC-USP, Mendonça disse que a técnica usada poderá ser útil para o desenvolvimento de novos fármacos. “As septinas participam de vários processos celulares e têm relação com algumas doenças, só que ainda é muito cedo para sabermos exatamente quais são os mecanismos envolvidos. Para entender a função dessas proteínas, é preciso entender sua estrutura. Dessa forma, podemos compreender como elas se polimerizam, conhecer os detalhes intermoleculares, para depois entender a função e, quem sabe, no futuro poder descobrir se existe alguma relação direta com as enfermidades e entrar em um caminho de aplicação.”
“Com este trabalho, vamos poder, em termos estruturais, entender melhor as anomalias e as engrenagens desse sistema”, acrescentou Garratt.
O artigo An atomic model for the human septin hexamer by cryo-EM pode ser lido em www.sciencedirect.com/science/article/abs/pii/S002228362100320X?dgcid=author.
* Com informações da Assessoria de Imprensa do IFSC-USP.