

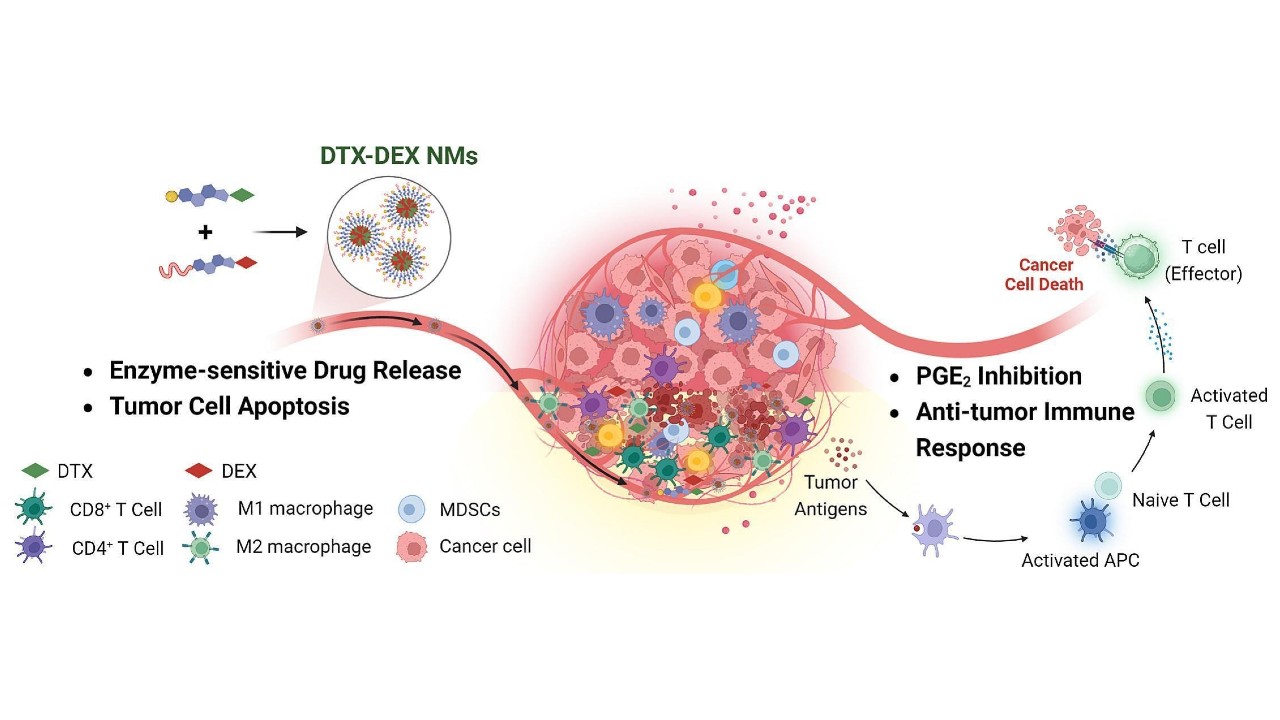
As nanomicelas quiméricas são compostas por fosfolipídios (NMs), docetaxel (DTX), substância usada para matar as células tumorais, e o anti-inflamatório dexametasona (DEX) (imagem: acervo dos pesquisadores)
Publicado em 22/04/2024
Ricardo Muniz | Agência FAPESP – Artigo publicado recentemente no Journal of Controlled Release detalha o resultado de colaboração científica internacional que desenvolveu uma alternativa para o tratamento dos tumores sólidos por meio da inibição do chamado microambiente tumoral inflamatório (tumour microenvironment ou TME).
Tumores sólidos costumam ser os tipos de câncer de tratamento mais desafiador por causa da dificuldade de penetração dos fármacos. O microambiente tumoral inflamatório, onde os tumores estão alojados, contém várias células e substâncias do próprio paciente que impedem as células de defesa de combater o tumor. “Muitas vezes essas células e moléculas ajudam o tumor a crescer e, por isso, dizemos que ele escapa da vigilância do sistema imune”, explica Lúcia Helena Faccioli, professora titular da Faculdade de Ciências Farmacêuticas de Ribeirão Preto da Universidade de São Paulo (FCFRP-USP) e coordenadora da Central de Quantificação e Identificação de Lipídeos (Ceqil), instalada com apoio da FAPESP por meio do Programa Equipamentos Multiusuários.
“Há sempre um cabo de guerra entre células imunológicas promotoras e inibidoras de tumores no TME, onde metabólitos, mediadores lipídicos, citocinas e quimiocinas desempenham um papel importante no domínio da natureza imunossupressora”, escrevem os autores do artigo, que incluem a pesquisadora Viviani Nardini, do Departamento de Análises Clínicas, Toxicológicas e Bromatológicas da FCFRP-USP, e cientistas de instituições indianas liderados por Avinash Bajaj, chefe do Laboratório de Nanotecnologia e Química Biológica do Centro Regional de Biotecnologia de Faridabad, no estado indiano de Haryana.
A equipe desenvolveu nanomicelas – partículas muito pequenas, medindo entre 1 e 100 nanômetros – compostas de diferentes substâncias e, por isso, chamadas de quimeras. As nanomicelas quiméricas produzidas são compostas por fosfolipídios (NMs), docetaxel (DTX), substância usada para matar as células tumorais, e dexametasona (DEX), um anti-inflamatório muito empregado para diminuir a produção de várias substâncias inflamatórias, como a prostaglandina E2 (PGE2).
Os estudos em animais de laboratório mostraram que essas partículas (NMs+DTX+DEX), ministradas por via intravenosa, foram muito eficientes, diminuindo o tamanho de tumores e aumentando a sobrevida dos animais: os não tratados morrem sempre ao redor de 28-30 dias, mas os tratados sobrevivem até 44-50 dias, explica Faccioli.
“O tratamento induziu uma diminuição superior a cinco vezes no volume do tumor em comparação com tumores não tratados no modelo de câncer de cólon”, detalha Bajaj. As nanomicelas reduziram e alteraram as células presentes ao redor do tumor, aquelas que impedem a ação do sistema imune, favoreceram o aumento de tipos específicos de leucócitos que matam células tumorais e também inibiram a liberação de PGE2, substância inflamatória presente no microambiente tumoral que diminui a ação antitumoral de determinadas células de defesa.
“Embora esses estudos tenham sido feitos em animais, os resultados são muito promissores e abrem possibilidades de estudos em humanos, já que as partículas são formadas por compostos já aprovados para utilização humana”, comemora Faccioli, que realizou seu pós-doutorado no National Heart and Lung Institute da Universidade de Londres.
Além da USP e do laboratório coordenado por Avinash Bajaj, participam da pesquisa o Amity Institute of Integrative Sciences and Health (Haryana), o Departamento de Cirurgia Oncológica do All India Institute of Medical Sciences (Nova Déli), o Instituto Nacional de Imunologia (Nova Déli) e o Instituto Nacional de Genômica Biomédica (Kalyani, Bengala Ocidental).
O artigo Engineered nanomicelles inhibit the tumour progression via abrogating the prostaglandin-mediated immunosuppression pode ser lido em: www.sciencedirect.com/science/article/pii/S0168365924001615.