

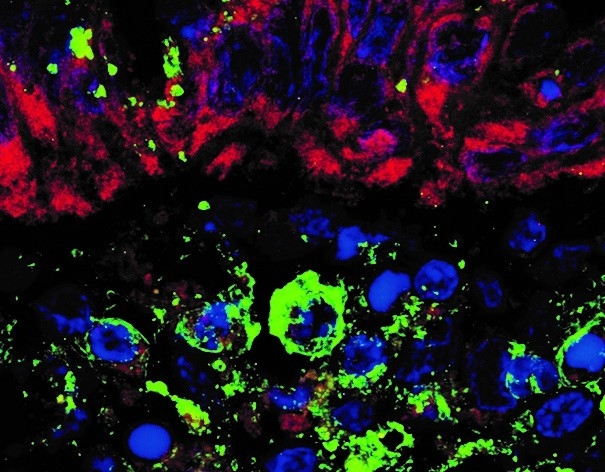
Biópsias intestinais infectadas com SARS-CoV-2 e coradas por imunofluorescência para a proteína humana ACE2 (vermelho) e para a proteína viral spike (verde). Os núcleos das células estão marcados em azul (imagem: Instituto de Biologia e Gastrocentro/FCM-Unicamp)
Publicado em 12/04/2021
André Julião | Agência FAPESP – Estudo conduzido na Universidade Estadual de Campinas (Unicamp) demonstra que compostos produzidos pela microbiota intestinal a partir da quebra de fibras alimentares não interferem na entrada ou replicação do vírus SARS-CoV-2 no intestino. Mas, embora o tratamento de células in vitro com essas moléculas não tenha apresentado relevância para a infecção local do tecido, ele reduziu a expressão de um gene importante para a entrada viral nas células e de um receptor de citocina que favorece a inflamação.
Os dados foram publicados na revista Gut Microbes.
Sintomas gastrointestinais como diarreia, vômito e dor abdominal podem acometer até 50% dos pacientes de COVID-19 e 17,6% dos casos graves. Essas alterações estão em parte associadas à entrada do vírus nas células intestinais e a alterações de suas funções normais. Além disso, estudos recentes indicam que indivíduos acometidos pela doença apresentam modificações importantes da microbiota intestinal, incluindo diminuição de bactérias que produzem ácidos graxos de cadeia curta – moléculas que regulam as células intestinais e de defesa do organismo.
Por conta disso, os pesquisadores testaram se esse tipo de ácido graxo teria efeito direto na infecção de células intestinais pelo SARS-CoV-2. Outros trabalhos já indicavam que a alteração na microbiota intestinal e em seus produtos poderia modificar a resposta imune durante o quadro infeccioso.
“Em trabalhos anteriores, observamos em animais que compostos produzidos pela microbiota intestinal participam da proteção contra infecção respiratória. Naquele caso, usamos como modelo o vírus sincicial respiratório [RSV], causador da bronquiolite e bastante comum em crianças. Resultados semelhantes foram obtidos em estudos conduzidos por outros grupos de pesquisa, com diferentes doenças respiratórias”, explica a bolsista de doutorado Patrícia Brito Rodrigues, que compartilha a primeira autoria do artigo com a pós-doutoranda Livia Bitencourt Pascoal. Rodrigues realizou a pesquisa como parte de seu doutorado no Instituto de Biologia (IB) da Unicamp, com bolsa da FAPESP (leia mais em: agencia.fapesp.br/31539).
No trabalho mais recente, amostras saudáveis de tecido do colón intestinal e de células epiteliais da mesma região foram infectadas com o novo coronavírus em laboratório e analisadas em seguida.
“Não houve diminuição da quantidade de vírus, que foi a mesma tanto nas células e tecidos tratados com os ácidos graxos de cadeia curta quanto nas amostras que não receberam o tratamento. No entanto, as amostras de biópsias intestinais tratadas apresentaram queda significativa na expressão do gene DDX58 [receptor do sistema imune inato que detecta ácidos nucleicos virais e ativa uma cascata de sinalização que resulta na produção de citocinas pró-inflamatórias] e do receptor de interferon-lambda, que medeia a atividade antiviral. Também ficou menos expressa a proteína TMPRSS2, importante para a entrada do vírus nas células”, diz Raquel Franco Leal, professora da Faculdade de Ciências Médicas (FCM) da Unicamp apoiada pela FAPESP e coordenadora do estudo junto com Marco Aurélio Ramirez Vinolo, professor do IB-Unicamp também apoiado pela Fundação.
Proteção contra inflamação
Os pesquisadores coletaram amostras de tecido do cólon de 11 pacientes sem COVID-19. Os testes foram realizados também em células epiteliais intestinais, que formam a parte mais superficial do intestino e ficam em contato próximo com a microbiota intestinal. Tanto as amostras de tecido quanto as células foram infectadas com o SARS-CoV-2 no Laboratório de Estudos de Vírus Emergentes (Leve), que tem nível 3 de biossegurança (NB3) e é coordenado por José Luiz Proença Módena, professor do IB-Unicamp e coautor do artigo.
Os tecidos e as células foram tratados com uma mistura de acetato, propionato e butirato, compostos obtidos no intestino por meio da metabolização, pela microbiota intestinal, dos ácidos graxos de cadeia curta presentes nas fibras alimentares. O tratamento não alterou a carga viral das biópsias intestinais nem das células. Não houve, tampouco, mudanças na permeabilidade e integridade das paredes celulares.
“Isso não exclui a possibilidade de os ácidos graxos de cadeia curta terem uma ação significativa na infecção pelo SARS-CoV-2. Talvez os efeitos antivirais dependam das interações com outras células do organismo. Vamos continuar investigando, agora em modelos animais, pois é possível que a ação desses compostos na infecção dependa de um sistema mais completo do que aqueles que utilizamos [células e tecidos isolados] in vitro”, afirma Rodrigues.
Outros testes mostraram, nas biópsias infectadas não tratadas, aumento da expressão do gene DDX58, que codifica um importante receptor viral. Além disso, verificou-se também maior expressão de interferon-beta (IFN-beta), molécula pró-inflamatória que participa do fenômeno conhecido como tempestade de citocinas, associado com os casos mais graves de COVID-19.
“As alterações de genes de reconhecimento e resposta a vírus durante a infecção intestinal podem ser relevantes para o início da cadeia inflamatória. Nesse contexto, será importante aprofundar as análises dos efeitos dos ácidos graxos de cadeia curta sob estes parâmetros, pois isso pode ser importante na fase mais grave da doença”, completa Leal.
O artigo Microbiota-derived short-chain fatty acids do not interfere with SARS-CoV-2 infection of human colonic samples pode ser lido em: www.tandfonline.com/doi/full/10.1080/19490976.2021.1874740.