

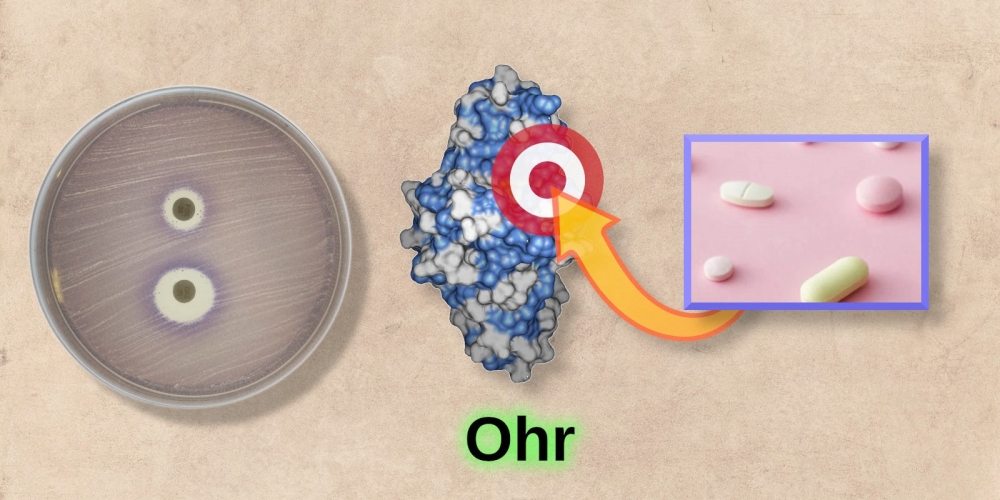
Em artigo de revisão, pesquisadores ligados ao CEPID Redoxoma descrevem diversos aspectos estruturais e funcionais do complexo formado pelas proteínas Ohr e OhrR, que tem papel central na defesa de patógenos contra danos oxidativos (imagem: Luis Netto/Redoxoma)
Publicado em 14/07/2022
Agência FAPESP* – Em artigo de revisão publicado na revista Free Radical Biology and Medicine, pesquisadores brasileiros apontam o sistema formado pelas proteínas Ohr (uma enzima antioxidante) e OhrR (seu fator de transcrição) como um potencial alvo a ser explorado na busca por novos antibióticos.
O trabalho foi coordenado por Luis Netto, professor do Instituto de Biociências da Universidade de São Paulo (IB-USP) e integrante do Centro de Pesquisa em Processos Redox em Biomedicina (Redoxoma) – um Centro de Pesquisa, Inovação e Difusão (CEPID) da FAPESP.
Há mais de 20 anos o grupo de Netto tem estudado esse sistema proteico, que desempenha papel central na defesa de patógenos contra danos oxidativos. No trabalho recentemente publicado, os pesquisadores descrevem aspectos da estrutura, catálise, filogenia, regulação e papéis fisiológicos das proteínas. O objetivo foi sistematizar informações que estavam dispersas na literatura.
Segundo os autores, o sistema Ohr-OhrR desempenha importantes funções na interface entre patógenos como Xylella fastidiosa, Pseudomonas aeruginosa, Chromobacterium violaceum e Bacillus cereus e seus hospedeiros – entre eles mamíferos e plantas vasculares. No entanto, os mecanismos envolvidos nessas interações são complexos e os papéis desempenhados por Ohr e OhrR nesses processos variam muito entre as diversas bactérias.
Como não são encontradas em animais vertebrados nem em plantas vasculares e têm características estruturais únicas, dizem os pesquisadores, as proteínas Ohr e OhrR podem ser alvos para o desenvolvimento de novos antibióticos – algo muito relevante, considerando o alarmante fenômeno das bactérias multirresistentes. Além disso, essas proteínas desempenham outras funções fisiológicas, como proteger bactérias simbióticas fixadoras de nitrogênio do estresse oxidativo associado a esse processo.
Para Netto, a pouca atenção dada ao sistema Ohr-OhrR é de certa forma surpreendente e poderia ser explicada por razões históricas. Enquanto as enzimas antioxidantes mais conhecidas foram descobertas a partir de 1937, a primeira Ohr só foi descrita em 1998, como uma proteína envolvida na resposta de bactérias ao estresse induzido por hidroperóxidos orgânicos, sendo que em 2000 cientistas brasileiros identificaram o gene que codifica essa proteína no genoma da Xylella fastidiosa, bactéria que causa uma doença chamada de clorose variegada dos citros (CVC), provocando grandes prejuízos à agricultura no Estado de São Paulo.
“Quando apareceu a Ohr no genoma da Xylella, não se sabia a atividade bioquímica dessa proteína. Como eu já tinha trabalhado com peroxirredoxinas, vi que a Ohr tinha duas cisteínas que eram muito conservadas. Aí surgiu a ideia: talvez seja uma peroxidase”, conta Netto, que fez parte do grupo responsável pelo sequenciamento do genoma da bactéria. O primeiro trabalho do grupo sobre a Ohr foi publicado em 2003, no Journal of Biological Chemistry, e demonstrou que de fato Ohr é um tipo de peroxidase.
O pesquisador enfatiza, no entanto, que a Ohr não é uma peroxirredoxina como descrito em alguns artigos. “A Ohr tem propriedades muito diferentes, como a sequência primária, a estrutura, a especificidade para redutor e oxidante e a dinâmica ao longo do ciclo catalítico.” As peroxirredoxinas (Prx), que também são foco de estudo do grupo de Netto, são proteínas antioxidantes consideradas sensores celulares de peróxido de hidrogênio.
Em 2020, o grupo elucidou seis estruturas cristalográficas da proteína Ohr do patógeno oportunista Chromobacterium violaceum, incluindo a estrutura do complexo entre a Ohr e seu substrato biológico, a dihidrolipoamida (DHL). Os pesquisadores identificaram intermediários do ciclo catalítico da enzima e reforçaram as evidências de que Ohr e Prx pertencem a classes diferentes de proteínas. Além disso, mostraram que a Ohr tem um colar hidrofóbico ao redor de seu sítio ativo, uma característica estrutural única que explica a especificidade dessa enzima para peróxidos orgânicos.
Inflamação
A resposta inflamatória é uma estratégia dos hospedeiros para combater microrganismos patogênicos e envolve a produção de várias moléculas oxidantes. Portanto, se uma inflamação demora para terminar, pode causar danos ao próprio hospedeiro. Hidroperóxidos orgânicos de ácidos graxos são oxidantes que também podem atuar como sinalizadores de processos tanto inflamatórios quanto anti-inflamatórios.
“A sinalização envolvida nesses processos de inflamação e de resolução da inflamação é bastante complexa, envolvendo diferentes hidroperóxidos de ácidos graxos, como dos derivados de ácido araquidônico”, conta Netto.
A hipótese levantada pelos pesquisadores é de que a Ohr poderia estar envolvida de alguma forma na virulência de patógenos via controle dos níveis desses hidroperóxidos lipídicos. “Acredito que o envolvimento biológico da Ohr poderia estar relacionado com o processo de resolução [finalização] da inflamação. Contraintuitivamente, se a bactéria tem muito antioxidante [no caso a enzima Ohr], acaba sendo ruim para ela e bom para o hospedeiro por, entre outros motivos, facilitar o recrutamento de células fagocitárias. Mas essa é uma hipótese ainda especulativa, que requer evidência experimental”, afirma o pesquisador.
A OhrR é a proteína que controla a transcrição do gene da Ohr. Para que a enzima antioxidante (Ohr) seja produzida, o gene que a codifica precisa ser transcrito para o RNA mensageiro correspondente. A OhrR quando está reduzida se liga ao DNA e impede a transcrição. Quando a célula está sob estresse oxidativo e é exposta ao peróxido orgânico, a OhrR é oxidada e sofre uma mudança estrutural que libera o DNA para ser transcrito e depois traduzido na proteína Ohr.
Como explica Netto, o próprio fator de transcrição é regulado por um processo redox (oxidação ou redução). “E ele vai induzir ou reprimir a expressão de uma proteína que tem propriedades que interferem no metabolismo dos hidroperóxidos orgânicos.”
Diversos grupos do CEPID Redoxoma estão envolvidos em estudos com hidroperóxidos orgânicos derivados de ácidos graxos, como os liderados pelos pesquisadores Sayuri Miyamoto e Paolo Di Mascio, bem como em estudos de cinética envolvendo a Ohr e a OhrR, como os grupos dos pesquisadores Ohara Augusto e Daniela Truzzi, ou ainda em estudos estruturais, como o grupo do pesquisador Marcos Antonio de Oliveira.
Em 2021, um grupo de pesquisadores chineses identificou o primeiro inibidor contra Ohr da bactéria Acinetobacter baumannii ATCC19606. O tratamento desse microrganismo com o inibidor de Ohr potencializou a atividade antibacteriana de antibióticos como canamicina e gentamicina. O grupo chinês entrou em contato com Netto, para colaboração no sentido de identificar moléculas com atividade microbicida mais potente.
O artigo Ohr – OhrR, a neglected and highly efficient antioxidant system: Structure, catalysis, phylogeny, regulation, and physiological roles pode ser acessado em: www.sciencedirect.com/science/article/abs/pii/S0891584922001472?dgcid=author.
* Com informações da Assessoria de Imprensa do Redoxoma.