

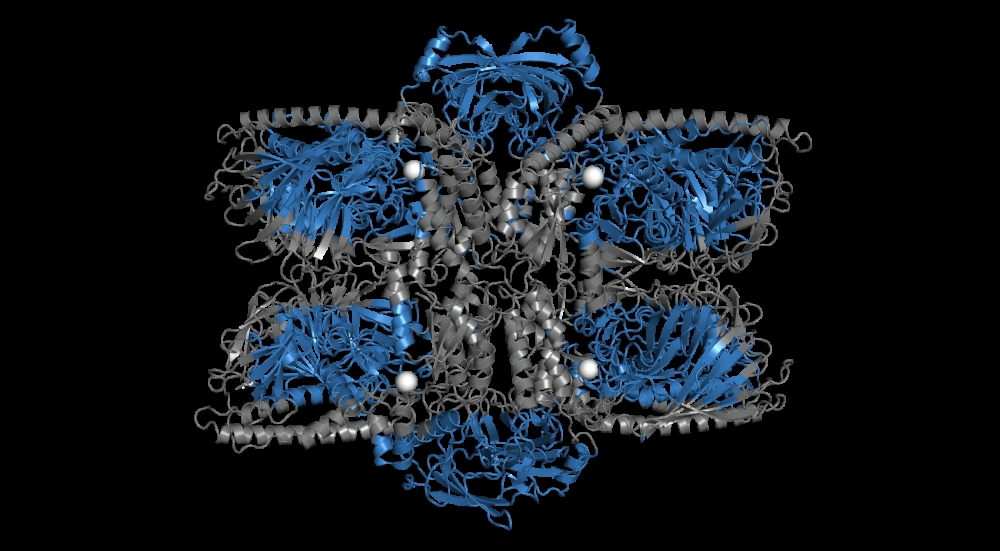
Em recém-nascidos, a Bifidobacterium longum é essencial para a digestão do leite; nos adultos, ajuda a transformar moléculas complexas, como carboidratos associados a proteínas, em fontes acessíveis de energia, como a glicose e a manose. As estratégias moleculares usadas nesses processos foram descritas na Nature Chemical Biology e podem inspirar o desenvolvimento de produtos probióticos e alimentícios para humanos e animais (estrutura tridimensional de uma enzima generalista d
Publicado em 08/03/2023
Maria Fernanda Ziegler | Agência FAPESP – No intestino de bebês recém-nascidos, uma bactéria conhecida como Bifidobacterium longum tem o papel fundamental de quebrar os carboidratos do leite e auxiliar na digestão da única fonte de alimento dos pequenos. Outra importante função da espécie é inibir a proliferação de microrganismos causadores de doenças, ajudando a equilibrar a microbiota intestinal.
Mesmo depois que o bebê cresce e passa a ter uma alimentação variada, essa bactéria probiótica persiste no intestino – agora com a função de metabolizar carboidratos associados a proteínas, moléculas conhecidas como N-glicanos.
Cientistas do Centro Nacional de Pesquisa em Energia e Materiais (CNPEM) descobriram que a persistência da B. longum no intestino adulto está justamente ligada ao fato de ela conseguir quebrar os N-glicanos – uma fonte de carbono perene nesse ambiente. Uma vez despolimerizados, esses carboidratos originam uma grande quantidade de monossacarídeos, ou seja, carboidratos simples, como glicose e manose, por exemplo.
No trabalho, apoiado pela FAPESP e divulgado na revista Nature Chemical Biology, os pesquisadores descrevem, pela primeira vez, o mecanismo molecular com que as bactérias degradam e metabolizam essas fontes de carbono. O achado abre caminho para o desenvolvimento de novos componentes para produtos alimentícios, rações para animais e produtos probióticos capazes de melhorar o funcionamento do intestino humano e de outros mamíferos.
“Descobrimos que, além de quebrar os carboidratos do leite, essas bactérias conseguem se manter em um ambiente tão competitivo como a microbiota intestinal por terem uma adaptação que as permite clivar e metabolizar os açúcares dos N-glicanos, que vêm das N-glicosilações de proteínas [adição de açúcar a proteínas] provenientes da alimentação ou do próprio trato intestinal. Vale ressaltar que os N-glicanos são oligossacarídeos química e estruturalmente complexos e nem todas as bactérias que habitam o trato intestinal conseguem clivá-los”, diz Mario Murakami, diretor científico do Laboratório Nacional de Biorrenováveis (LNBR-CNPEM).
Para elucidar todas as estratégias moleculares empregadas pela bactéria para a sobrevivência na microbiota, desde a fase neonatal até a vida adulta, os pesquisadores combinaram análises bioquímicas, mutação sítio-dirigida, espectrometria de massas, criomicroscopia eletrônica de alta resolução (crio-EM) e simulações de dinâmica molecular.
Colaboraram pesquisadores da Universidade Estadual de Campinas (Unicamp), da Emory University (Estados Unidos), da Maryland University (Estados Unidos) e do Biocruces Bizkaia Health Research Institute (Espanha).
Para a vida toda
Os autores descobriram que, além das bactérias B. longum possuírem genes que permitem utilizar os carboidratos do leite, elas também apresentam sistemas enzimáticos para a degradação de outros tipos de carboidratos. Murakami explica, que dada a complexidade dos N-glicanos, a bactéria precisa de um conjunto diverso de enzimas, com diferentes modos de ação e mecanismos de reconhecimento do substrato [molécula-alvo de uma enzima], para quebrar todas as ligações químicas presentes nesses carboidratos, além de requerer diversas enzimas para metabolizar os açúcares gerados pela degradação dos N-glicanos.
“A estrutura dos N-glicanos lembra a dos galhos das árvores. Esses galhos são compostos por distintos monossacarídeos, como manose, glicose e N-acetilglicosamina, e estão conectados por pelo menos cinco diferentes ligações químicas, gerando uma complexidade estrutural e química recalcitrante para degradação bioquímica. A partir desse estudo, conseguimos entender em nível molecular e atômico como o sistema enzimático constituído por nove enzimas de B. longum age de forma cooperativa para a desconstrução desses carboidratos complexos”, conta Murakami à Agência FAPESP.
Um aspecto interessante do trabalho foi que, ao desvendar o processo usado por essas bactérias probióticas para a clivagem de oligossacarídeos complexos, os pesquisadores descobriram também uma série de características inusitadas da B. longum.
Um exemplo é o processo metabólico raro usado por essas bactérias para metabolizar a manose. “Primeiro é isomerizada [transformação que mantém a fórmula molecular, mas altera as propriedades físicas e químicas] em frutose para depois ser fosforilada [adição de um grupo fosfato na molécula]. Porém, na grande maioria das bactérias que metabolizam a manose, ela primeiro é fosforilada e depois isomerizada. A B. longum atua por uma rota metabólica invertida em relação à usual”, explica Murakami.
Outro achado está no sofisticado mecanismo de cooperação de quatro enzimas que atuam na clivagem das ramificações de manose. Os pesquisadores verificaram que uma enzima sozinha – uma α-mannosidase da família GH38 (Bl_Man38B) – tem modo de ação generalista atípico e consegue desconstruir o N-glicano por inteiro.
Apesar da enzima Bl_Man38B ser capaz de atuar em todas as ramificações dos N-glicanos, ela ainda pode ser potencializada pela ação de uma outra enzima (α-mannosidase da família GH125), altamente específica para ligações do tipo α-1,6, acelerando o processo de degradação dos N-glicanos, que pode ser ativado em condições de estresse ou escassez nutricional.
Além disso, o mesmo processo de degradação pode ser feito pela ação cooperativa de outras duas enzimas (α-mannosidases da família GH38, Bl_Man38A e Bl_Man38B), que atuam de forma complementar sobre as distintas ligações do tipo α-1,2, α-1,3 e α-1,6. Murakami ressalta que a atuação das enzimas tem como destaque uma redundância funcional inédita para esse sistema em bactérias.
“Aprendemos com o estudo de outros filos bacterianos que geralmente as enzimas atuam de forma complementar, cada uma sendo responsável por uma etapa específica e sequencial do processo de clivagem e metabolismo. Mas observamos um mecanismo mais complexo em bifidobactérias envolvendo enzimas altamente específicas associadas com outras generalistas, o que gera um arsenal bioquímico singular e redundante para garantir a completa degradação de N-glicanos”, comenta o pesquisador.
Segundo Murakami, a B. longum apresenta um gene que codifica a enzima α-glicosidase, que permite a remoção de monoglicosilações na extremidade das antenas dos N-glicanos. Isso possibilita à bactéria também utilizar os N-glicanos não maduros. “Essa monoglicosilação bloqueia toda a desconstrução do N-glicano. As bactérias que não têm essas enzimas não conseguem utilizar os N-glicanos não maduros como fonte de carbono. Portanto, ter esse sistema enzimático versátil confere uma vantagem bioquímica à B. longum para ampliar seu espectro de atuação sobre todas as formas variantes dos N-glicanos ricos em manose”, explica.
O artigo Mechanism of high-mannose N-glycan breakdown and metabolism by Bifidobacterium longum pode ser lido em: www.nature.com/articles/s41589-022-01202-4.
A pesquisa do CNPEM foi objeto de uma resenha crítica publicada pela professora da Universidade de Birmingham (Reino Unido) Lucy Crouch na mesma edição da revista Nature Chemical Biology. Esse texto pode ser conferido em: www.nature.com/articles/s41589-022-01199-w.