


Estudo identificou o sítio crítico para identificação de ameaças no cérebro de roedores (imagem: Pexels*)
Publicado em 29/07/2024
Ricardo Muniz | Agência FAPESP – Artigo publicado na revista Current Biology descreve experimentos que possibilitaram mapear com precisão locais no cérebro responsáveis pela identificação imediata de ameaças e pela formação de memória de medo.
“Estávamos interessados em ver uma região do cérebro relacionada à sinalização de medo, como ela poderia identificar ambientes relacionados previamente a uma ameaça física ou predatória, como um local em que o indivíduo sofreu um estímulo físico eversivo [que causa destruição]”, conta Newton Sabino Canteras, professor titular do Departamento de Anatomia do Instituto de Ciências Biomédicas da Universidade de São Paulo (ICB-USP) e um dos autores do artigo.
O hipocampo sabidamente está envolvido na navegação espacial e orientação do corpo no ambiente – e também agrega as ameaças ambientais. O registro do que for perigoso vai ser “jogado” lá, de tal maneira que é possível computar no ambiente de onde vem a ameaça, explica o cientista. Outra estrutura que faz parte do hipocampo é o subículo.
“Basicamente essa é a estrela do espetáculo. Ela transfere as informações ligadas à ameaça ambiental ao hipotálamo. Então nossa pergunta foi como essa estrutura se comporta quando o animal está frente a um ambiente previamente associado a um estímulo aversivo”, conta Canteras.
Para observar a atividade desse núcleo, o grupo utilizou fotometria de fibra. “Colocamos um vírus que expressa uma proteína sensível à entrada de cálcio e pode registrar a atividade celular. Conforme há atividade celular, vai emitindo mais fluorescência.”
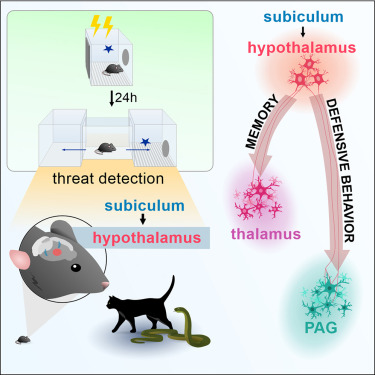
Resumo gráfico da pesquisa (crédito: Juliette M.A. Viellard et al./Current Biology)
O paradigma comportamental usado foi habituar um camundongo em um aparato com duas caixas ligadas por um corredor. Numa dessas caixas, o roedor foi confinado e recebeu estímulos físicos aversivos (choque nas patas). No dia seguinte, o animal foi colocado no aparato experimental de forma a evitar a caixa aversiva.
“Normalmente, quando é testado assim, ele estica o corpinho, vai e volta, mas não entra mais na caixa onde recebeu o choque, tem uma série de reações que a gente chama de evitação.”
Na análise fotométrica com foco no núcleo pré-mamilar dorsal (PMd), uma interface crítica do circuito neuronal investigado, foi detectado que o PMd fica particularmente ativo quando o animal se direciona ao local aversivo e apresenta um aumento ainda maior da atividade quando fica próximo da fonte ameaçadora.
“Trata-se, portanto, de um detector de ameaça muito claro, que interage de forma dinâmica com a fonte. Se o rato virar de costas, não é ativado, mas se olha para ela ou fica próximo, o PMd vai ‘apitar’, e esse é um dos grandes achados do trabalho”, relata Canteras.
Na sequência, os pesquisadores inativaram o núcleo utilizando quimiogenética (designer receptors exclusively activated by designer drug – Dreadd). “A gente injeta um vírus, esse vírus expressa um receptor [a proteína hM4Di] que, na presença de uma droga específica, vai ‘silenciar’, ou seja, impedir que essas células disparem. Fica silenciado só no momento em que dou a droga. No momento em que eu tiro, funciona normalmente”, detalha Canteras. “Quando faço essa inativação do núcleo, o animal reduz drasticamente a resposta de defesa, deixa de evitar a caixa ameaçadora, vai lá e entra, como se o ambiente fosse inócuo, como se nada tivesse acontecido.”
Notou-se que a inativação do PMd influencia tanto a expressão das respostas de defesa como o processo de reconsolidação da memória de medo. Ou seja, após a inativação do PMd o animal registra o ambiente como seguro e, no dia seguinte, navega pelo ambiente como se não houvesse qualquer risco.
Na sequência foram investigados os papéis funcionais dos principais alvos do PMd, a saber: a substância cinzenta periaquedutal (PAG) e o tálamo medial anterior (AM) – dois sítios do sistema nervoso, um no tronco e outro no tálamo.
“Há uma técnica pela qual posso inativar especificamente a projeção que vai para o tronco ou a que vai para o tálamo. Coloco um vírus no PMd que expressa uma proteína que é um canal de cloro sensível à luz. Quando jogo luz nos campos terminais, essas terminações silenciam, então posso manipular uma via específica de projeção.”
Os pesquisadores verificaram que, quando é inativada a via da projeção para a PAG, o efeito é a diminuição do comportamento de defesa no momento de inativação da via. Mas, no dia seguinte, o rato responde bem ao medo, ou seja, não altera a memória.
“Vai influenciar principalmente a expressão do comportamento, mas não vai influenciar na reconsolidação da memória de medo”, detalha o pesquisador. “Por outro lado, quando é feita uma inativação para o tálamo quase não tenho efeito imediato, mas tenho um grande efeito na reconsolidação da memória de medo.” Assim, os dois eventos estão sendo principalmente mediados por sítios diferentes de projeção do núcleo.
O artigo tem como primeiros autores Juliette Viellard (ICB e Institut des Maladies Neurodégénératives da Universidade de Bordeaux, França) e Fernando Melleu (ICB), e como coautores Alicia Tamais, Alisson de Almeida, Carolina Zerbini, Juliane Ikebara, Karolina Domingues, Miguel de Lima, Simone Motta (todos do ICB) e Fernando A. Oliveira, do Laboratório de Neurobiologia Celular e Molecular do Centro de Matemática, Computação e Cognição da Universidade Federal do ABC.
O grupo recebeu apoio da FAPESP por meio de dez projetos (17/12881-2, 14/05432-9, 16/18667-0, 19/27245-0, 16/08640-7, 22/07530-4, 21/02864-9, 22/16318-9, 21/01642-2 e 18/25857-5).
O artigo A subiculum-hypothalamic pathway functions in dynamic threat detection and memory updating pode ser lido aqui: www.sciencedirect.com/science/article/abs/pii/S0960982224006043.
*Foto de Tanner Johnson em Pexels