

Pesquisadores do CEPID Redoxoma demonstraram a presença de ligações cruzadas de resíduos de triptofano e tirosina em amostras humanas (imagem: Free Radical Biology and Medicine)
Publicado em 23/04/2021
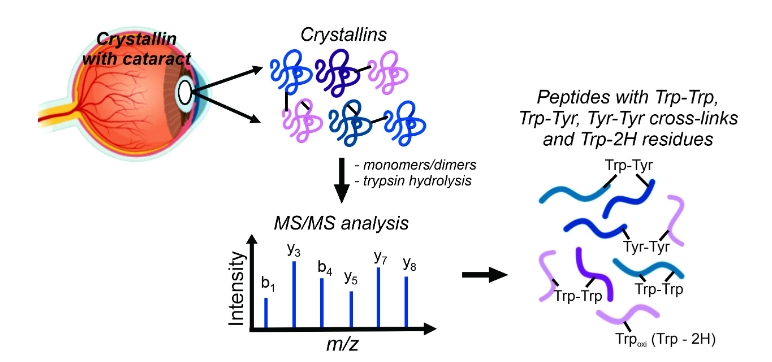
Agência FAPESP * – Pesquisadores do Centro de Pesquisa em Processos Redox em Biomedicina (Redoxoma), um Centro de Pesquisa, Inovação e Difusão da FAPESP (CEPID), com sede no Instituto de Química da Universidade de São Paulo (IQ-USP), demonstraram a presença de ligações cruzadas de resíduos de triptofano e tirosina em amostras humanas de catarata, produzidas por mecanismos radicalares.
A formação de ligações cruzadas e consequente agregação de proteínas são modificações proteicas, oxidativas ou não, consideradas um dos principais fatores que contribuem para a opacidade na catarata.
“É a primeira vez que dois tipos de ligações cruzadas, triptofano-tirosina e triptofano-triptofano, são identificados inequivocamente por espectrometria de massas em amostras humanas extremamente complexas, com inúmeras modificações proteicas”, afirma Ohara Augusto, pesquisadora responsável pelo CEPID.
A relevância do trabalho é mais científica do que clínica, ela ressalva. “Se essas ligações cruzadas estão envolvidas no mecanismo patogênico da catarata ainda terá de ser estudado. Estamos abrindo perspectivas para novos estudos. Por ser uma modificação radicalar, alguns antioxidantes como nitróxidos, glutationa ou ácido ascórbico podem ser eficientes para interromper o processo. Essa é uma possibilidade a ser testada. Seria muito importante prevenir ou retardar o desenvolvimento da catarata”, diz a pesquisadora.
Como a lente de uma câmera fotográfica, o cristalino tem como função focar a luz na retina para uma visão nítida, além de ajustar o foco do olho, permitindo que enxerguemos com clareza tanto de perto quanto de longe. A catarata é a turvação do cristalino, sendo a causa mais comum de perda de visão em pessoas com mais de 40 anos e também a principal causa de cegueira no mundo.
Segundo o primeiro relatório mundial sobre visão publicado pela Organização Mundial da Saúde (OMS) em 2019, há mais de 65 milhões de pessoas com catarata no mundo. Com o envelhecimento da população, esse número tende a aumentar. Por enquanto, o único tratamento disponível é a remoção cirúrgica do cristalino e implantação de lentes intraoculares artificiais. Esse procedimento geralmente é eficaz, mas não sem risco de complicações.
“A catarata é uma doença que afeta milhões e ainda não há um mecanismo definido de como ela se desenvolve. O que se sabe é que a agregação de proteínas promove a desestabilização da estrutura das proteínas que compõem o cristalino, levando à opacificação. Nosso trabalho vai contribuir para a compreensão desse processo, para que o tratamento da catarata seja possível no futuro”, diz Verônica Paviani, primeira autora do artigo, publicado na revista Free Radical Biology & Medicine (FRBM).
O estudo foi realizado durante o doutorado de Paviani, que atualmente é pós-doutoranda na Feinberg School of Medicine of Northwestern University, em Chicago, e contou com a colaboração do grupo de Amaryllis Avakian, chefe do Departamento de Cirurgia de Catarata do Hospital das Clínicas da Faculdade de Medicina da USP, e do professor Paolo Di Mascio, do IQ-USP e do CEPID Redoxoma.
Nanoestrutura ordenada e interativa
O cristalino humano é composto em grande parte por proteínas da superfamília cristalino (alfa, beta e gama-cristalino) reunidas em uma macroestrutura altamente ordenada e interativa, essencial para a transparência da lente e para o índice de refração da luz. São proteínas que não sofrem turnover, ou seja, elas não são degradadas e repostas. Dessa forma, estão sujeitas a inúmeras modificações, refletindo as alterações que as proteínas sofrem depois de serem sintetizadas.
Essas proteínas possuem muitos triptofanos, que são aminoácidos facilmente oxidados, além de serem os que mais absorvem luz na região do ultravioleta (UV), dentre os 20 aminoácidos que compõem as proteínas.
A oxidação do triptofano leva à formação do radical triptofanil, que, ao se recombinar, produz uma ligação cruzada, formando um dímero. Ligações cruzadas são ligações covalentes entre duas cadeias laterais de aminoácidos.
Segundo as pesquisadoras, embora se soubesse desde a década de 1940 que o triptofano é sensível à oxidação por luz, essa dimerização ainda não havia sido detectada.
Luz contínua e o desenvolvimento da catarata
Em artigo publicado em 2010, o grupo de Ohara caracterizou pela primeira vez a formação de uma ligação cruzada de ditriptofano na enzima superóxido dismutase humana (hSOD1) durante sua atividade de peroxidase dependente de bicarbonato, no caso por reações mediadas pelo radical carbonato.
“Descobrimos que a luz UV também pode promover a formação de ligações cruzadas de triptofano, o que deu a ideia de procurar esse tipo de modificação na catarata, que é um contexto que envolve a oxidação por luz”, afirma Paviani. Existem muitas evidências de que a luz contínua a que somos expostos desde o nascimento tenha um papel no desenvolvimento da catarata.
Para investigar essa hipótese, os pesquisadores analisaram as proteínas da lente de três pacientes com idade de 64 a 78 anos contendo catarata nuclear em estágio avançado. Utilizando a técnica de cromatografia líquida acoplada à espectrometria de massas (LC-MS/MS), eles investigaram e caracterizaram ligações cruzadas triptofano-triptofano, triptofano-tirosina e tirosina-tirosina nas amostras.
Em experimentos paralelos, irradiaram beta cristalinos bovinos com um simulador solar e verificaram a formação de ligações cruzadas semelhantes. O beta cristalino bovino foi escolhido por ter grande homologia com o humano, ou seja, as sequências das proteínas são muito similares.
A identificação dessas modificações não é trivial. “Esses agregados podem ser facilmente visualizados por um experimento de SDS-PAGE, no qual vemos as bandas das proteínas em um gel. Entretanto, essa é uma metodologia muito simples que não permite a identificação das proteínas ou dos aminoácidos envolvidos na ligação. Nós partimos para uma abordagem de espectrometria de massas, uma metodologia muito mais apurada”, explica Paviani.
O desafio da espectrometria de massas foi conseguir analisar milhares de espectros de peptídeos sobrepostos para identificar as modificações de interesse. “Desenvolvemos um método para selecionar os peptídeos que estavam formando ligações cruzadas. Hoje existem softwares para procurar modificações proteicas, mas, até o momento, não temos um software suficientemente adequado para permitir identificar esses tipos de ligações cruzadas. Por isso o desafio foi tão grande”, acrescentou.
“Usamos critérios muito estritos para buscar as ligações cruzadas e provavelmente por isso caracterizamos um pequeno número delas, mas de forma muito consistente. Considero que muitas outras dessas ligações devem estar presentes em cataratas”, conclui Ohara.
O artigo Human cataractous lenses contain cross-links produced by crystallin-derived tryptophanyl and tyrosyl radicals, assinado por Verônica Paviani, Paulo Junqueira de Melo, Amaryllis Avakian, Paolo Di Mascio, Graziella Eliza Ronsein e Ohara Augusto, está acessível no endereço www.sciencedirect.com/science/article/abs/pii/S0891584920312156.